You are not logged in.
Oferta
- Badania dostępności farmaceutycznej:
- badania specyficznej (wg FP i Ph. Eur. 2.9.29 oraz USP <1087>) i pozornej (wg FP i Ph. Eur. 2.9.43) szybkości rozpuszczania substancji leczniczych.
- opracowywanie metod badania uwalniania, zarówno w zakresie optymalizacji warunków badania uwalniania jak i walidacji metod oznaczania stężenia substancji leczniczych w płynach do uwalniania (UV-VIS, HPLC);
- zgodne z metodologią Zleceniodawcy i/lub wymaganiami Farmakopei Polskiej, Europejskiej i Amerykańskiej oraz przewodnikami FDA/EMA/WHO/ICH oraz danymi z piśmiennictwa naukowego;
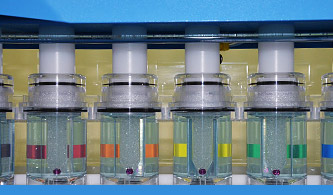
- uwalnianie substancji leczniczych z różnych postaci leków: proszków, granulatów, peletek, zawiesin, tabletek, kapsułek twardych, miękkich kapsułek żelatynowych, czopków, globulek, kremów, maści, żeli oraz z nośników leków takich jak liposomy, nanocząstki, mikrosfery, implanty, stenty, szkła kontaktowe. W zależności od postaci leku badania uwalniania lub przenikania substancji czynnych mogą zostać wykonane w aparacie koszyczkowym, łopatkowym, przepływowym (półautomatyczny zestaw szwajcarskiej firmy SOTAX);
- badanie uwalniania z postaci leku w warunkach zbliżonych do warunków in vivo oraz możliwość przedklinicznej oceny właściwości biofarmaceutycznych postaci leku, równoważności farmaceutycznej, określenie możliwości odstąpienia od klinicznych badań biorównoważności, oszacowanie prawdopodobieństwa sukcesu/porażki w badaniach biorównoważności, wyznaczenie zależności in vitro/in vivo (IVIVR), wyznaczenie i ocena korelacji in vitro/in vivo (IVIVC).
- Statystyczna analiza danych:
- walidacja metod pomiarowych: statystyki opisowe, ocena wartości odstających, ocena normalności rozkładu pomiarów, ocena niepewności pomiarów, ocena zakresu metody, ocena liniowości, wyznaczanie prostej kalibracji, wyznaczanie granicy wykrywalności (LOD) i oznaczalności (LOQ), obliczenie dokładności (odzysk), poprawności, precyzji, odtwarzalności, powtarzalności i stabilności;
- porównanie profili uwalniania: dobór odpowiedniego testu (metody zależne i niezależne od modelu), przygotowanie raportu z przeprowadzonej statystycznej oceny podobieństwa preparatów pod względem dostępności farmaceutycznej;
- prace badawcze oraz optymalizacja metod analitycznych i procesów: dobór odpowiednich metod modelowania, planowanie doświadczeń (Design of Experiments – DoE) – projektowanie receptury postaci leku jak i procesu technologicznego, weryfikacja istotności wprowadzonych zmian, definiowanie przestrzeni projektowej (Design Space wg koncepcji Quality by Design – QbD).
- Usługi eksperckie (konsultacje, ekspertyzy – sporządzenie raportu ze stanu wiedzy w oparciu o przegląd piśmiennictwa naukowego, szkolenia) w zakresie: technologii postaci leku, analityki i analizy farmaceutycznej, statystycznej analizy danych dla przemysłu farmaceutycznego.
- Usługi pomiaru rozkładu wielkości cząstek metodą dyfrakcji laserowej zgodne z metodologią Zleceniodawcy i/lub wymaganiami Farmakopei Polskiej/Europejskiej/Amerykańskiej oraz ICH. Opracowanie i walidacja metody pomiaru wielkości cząstek. Katedra dysponuje analizatorem Mastersizer® 3000 firmy Malvern umożliwiającym pomiary na sucho (przystawka Aero S) oraz w dyspersji cieczowej (przystawki MV i SV) z możliwością wizualizacji cząstek w trakcie pomiaru (przystawka HydroSight – rejestracja filmów, zdjęć i serii ujęć dyspersji w czasie rzeczywistym).
- Usługi liofilizacji zgodne z metodologią Zleceniodawcy lub z opracowaniem metody (liofilizator Epsilon 2-4 LSCplus, Christ)
Zainteresowanych ofertą prosimy o kontakt:
- Prof. dr hab. n. farm. Janina Lulek – tel. 61 854 66 60, e-mail: jlulek@ump.edu.pl
- Dr n. farm. Bartłomiej Milanowski – tel. 61 854 66 59, e-mail: bmilan@ump.edu.pl
- Centrum Transferu Technologii Medycznych w Poznaniu Sp. z o.o. – Zdzisław Podrez, e-mail: zpodrez@ump.edu.pl
Data aktualizacji: 25 marca 2019